ד"ר סקוט גוטליב, שפרש לפני כמה חודשים מניהול ה-FDA (רשות המזון והתרופות האמריקאית), הוא כנראה בעל התפקיד הזה ששמו היה הכי מוכר אי פעם לאזרח האמריקאי מהרחוב. אולי אפילו לישראלים. במסגרת תפקידו נגע גוטליב בנושאים מעוררי מחלוקת, כמו עישון ותחליפי עישון באידוי, קנאביס, מחירי תרופות, חיסונים, ממשקים בין בריאות למזון ועשה גם מהפכה בקצב אישור התרופות.
הוא החל את דרכו ככלכלן ורופא פנימאי. אחרי ששימש במספר תפקידים בתעשייה ובמספר תפקידים ב-FDA, הוא מונה על ידי נשיא ארה"ב דונלד טראמפ לראש הרשות. למרות שהוא מזוהה עם הצד השמרני של המפה הפוליטית, לא תמיד ניתן היה לדעת כיצד יפסוק בסוגיות הקשורות לשוק חופשי. הוא האיץ משמעותית תהליכים ברשות, לשמחתן של חברות התרופות, אך לא חסך ביקורת ורגולציה מתעשיות אחרות, כמו הסיגריות האלקטרוניות והקנאביס.
עזיבתו את התפקיד לפני מספר חודשים, אחרי שנתיים בלבד, הפתיעה רבים. הוא עזב רשות שבמידה רבה הפכה להיות בדמותו, למרות הזמן הקצר שכיהן בתפקיד. נראה כי גם לו עצמו הייתה הפרידה קשה, בהתחשב בתדירות שבה הוא מתבטא במדיה ובטוויטר, לגבי עניינים הנוגעים לרשות.
גוטליב הגיע לישראל כדי להרצות ולהיפגש עם גורמים ישראלים בכנס של בנק ההשקעות HC Wainwright, אחד מכנסי הדגל של חברות הביוטק הציבוריות בישראל, שנערך השבוע זו הפעם החמישית.
מה היה בעיניך ההישג הכי משמעותי שהשגת ב־FDA?
גוטליב: "הקדנציה שלי התבררה כתקופה היסטורית, כי במהלכה הגיעו לשוק כמה תרופות וטכנולוגיות מאוד חדשניות, שלא כל כך התאימו לפרוטוקול האישורים והניסויים הקיים. למשל, בריאות דיגיטלית, תאי גזע ועריכה גנטית. היינו צריכים לבנות מאפס תשתיות לבדיקה ולאישור המוצרים. הייתה הרבה התלהבות סביב החדשנות הזו בארגון, שהשפיעה על התרבות הארגונית שלנו. אני מאמין שהציבור חש בכך. אני חושב שהיום הציבור יותר מאמין ברשות ויותר מעריך אותנו".
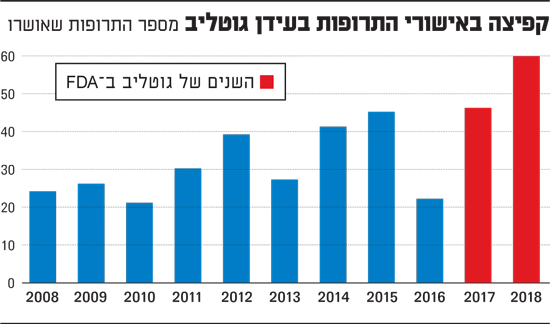
בתקופה שהיית ראש הארגון אושרו מוצרים במהירות השיא.
"רשמנו שתי שנות שיא במספר התרופות המאושרות, 2017 ו-2018. אני לא בטוח שהשיאים הללו יישברו כל כך מהר".
קפיצה באישורי התרופות בעידן גוטליב
אישורים מהירים ובטוחים לתרופות
כשהחל לעלות מספר האישורים, היו שאמרו כי ה־FDA פועל כמטוטלת. כשיש משבר בטיחותי סביב תרופה, למשל ויוקס של חברת מרק שהתברר שגרמה לתופעות לוואי קטלניות, פתאום ה־FDA הופך קשוח וביקורתי יתר על המידה. אחר כך המשבר נשכח וישנה הקלה בנהלים, עד המשבר הבא.
"אני מאמין שאפשר לספק גם מהירות וגם בטיחות ואני כמובן חושב שזה מה שעשינו. אני לא חושב שיכול לקרות היום משבר ויוקס נוסף".
אילו שינויים ספציפיים עשיתם במודל אישור התרופות?
"בנינו מודלים הרבה יותר מגוונים לאישור תרופות, לעומת השיטה הקלאסית של ניסויי ענק מבוקרים מול קבוצת ביקורת, ומעקב של שנים אחר המטופלים כדי לראות שאין נזק, עוד לפני מתן האישור.
"למשל, בתחום התרפיה הגנטית הבנו שניתן להראות יעילות של המוצר בחולים ספורים, ואילו את בעיות הבטיחות ניתן יהיה לראות רק עוד שנים רבות. כמה שנים אפשר לומר לחברות לחכות לאישור לפני שנחבל בכל ההתפתחות של התחום הזה? החלטנו שבמחלות מסוימות, שבהן יש צורך חזק ואין הרבה מה להפסיד (כמו למשל סרטן סופני או מחלה גנטית קטלנית בילדים - ג"ו), אנחנו נאפשר רישוי מהיר על בסיס ניסוי קטן, ואחר כך נבצע מעקב מאוד צמוד אחרי תופעות הלוואי בעולם האמיתי, לטווח הארוך.
"כשנכנסתי לתפקיד לא היו תקנות למוצרים בתחום תאי הגזע, הן משום שלא ידעו כיצד לבחון אותם והן משום שאפשר היה לומר שאלה תאים שממילא מגיעים מגוף המטופל, במינון או ריכוז אחרים - אז נראה על פניו שזה בטוח. אבל המצב בפועל היה שהתאים הללו כן עברו מניפולציות שונות לפני שהוחזרו לגוף, וכמה חברות השתמשו במוצרים הללו בצורה לא אחראית. היה לחץ ציבורי לסדר את התחום.
"אני זוכר מקרה אחד, שהוא גם היחידי, שבו הייתי צריך במסגרת תפקידי כראש ה-FDA לקרוא לאף.בי.אי כדי שייכנס לתוך חברת ביוטק ויתפוס מוצר כראיה. מישהו יצר מוצר שהיה שילוב בין תאי גזע לבין חיסון חי מוחלש לאבעבועות שחורות. אלוהים יודע מאיפה הוא השיג אותו. התביעה נגדו הראתה לשוק שאנחנו באמת רציניים ולא נהסס לפעול נגד מי שמסכן את הציבור".
את המוצרים שלא היוו סכנה לציבור, חילקו ב-FDA לשני סוגים. מוצרים לתחום האסתטי נבחנו רק כדי לבדוק אם יש בהם סיכון. גוטליב חש כי בדיקה מדוקדקת האם הזרקת תאי גזע לעור אכן מעניקה מראה צעיר יותר - היא בזבוז משאבים של הרשות. לעומת זאת, מוצרים שטוענים טענה רפואית, עברו למסלול רגולציה קצת יותר דומה לזה של תרופות רגילות, אך ניתנו להם הקלות מסויימות.
גישות חדשניות לאישור טיפולים
לחברות הלא-שרלטניות הוגבר הפיקוח, אך ניתנו גם הקלות. למשל, ניתנה אפשרות לכמה חברות לבצע את ניסויי הבטיחות שלהן יחד, משום שהשתמשו באותם תאי גזע. כל אחת השתמשה בהם ליישום אחר. על פי התקנות הקודמות, כל מוצר היה צריך לבצע ניסויי בטיחות משלו.
בתחום האלצהיימר הגישה הייתה אפילו יותר מהפכנית. גוטליב מסביר, כי כל חברות התרופות "רודפות" אחרי קהילה קטנה של חולים שיש לה גן מסוים, המאפשר לדעת בסבירות גבוהה כי האדם עומד לחלות, עוד לפני התפתחות המחלה במלוא עוצמתה. ה-FDA אפשר לגייס את החולים הללו לניסוי, שהכיל כמה תרופות כאלה והמטופלים הועברו מתרופה לתרופה. כך אפשר היה לדעת כיצד משתווה כל אחת מן התרופות לכל האחרות ולתרופת דמה, והחברות לא נאלצו להתחרות זו מול זו על גיוס החולים באופן שעיכב את הניסוי.
בתחום הסרטן, במקרה שבו החברות זיהו מנגנון מסויים בסרטן שמגיב לתרופה שלהן, ויתרה הרשות על החלוקה של הסרטן לפי איברים. כך, אפשר לעשות היום ניסוי לסרטנים המבטאים גנים מסוימים, כאשר 10 מהם חולים בסרטן המעי, 10 בסרטן כבד וחמש בסרטן השד. לו היו החברות צריכות לגייס 25 חולים בסרטן באיבר מסוים וגם עם המסלול המולקולרי המסוים, ייתכן שלעולם לא היו יכולות לסיים את הניסוי.
בתחום הבריאות הדיגיטלית נקטה ה-FDA בגישה לפיה כל ניסיון לפקח על כל מוצר חדש נדונה להיכשל בשל תדירותם של החידושים. גוטליב מצא לכך פתרון מעניין. במקום לפקח על טכנולוגיות, החליט לפקח על חברות. כל עוד נראה, שהחברה פועלת כראוי בתכנון ובקרה של המוצרים שלה, הרי שיש להניח שכל גרסה חדשה של המוצר, תהיה גם היא ראויה.
אולם, יש לו גם מילות אזהרה עבור חברות הבריאות הדיגיטלית. "מנהלי החברות הללו חושבים שהאיום הגדול על פעילותן הוא סוגיית פרטיות המידע. זה חשוב מאוד, אך להערכתי זה לא האיום הגדול, כי החברות יודעות לעשות זאת היטב.
"האיום האמיתי הוא שאלת איכות המידע. כלומר, עד כמה באמת ברור לחברה שאפשר לקבל החלטות רפואיות נכונות ובטוחות באמצעות המידע שלה ללא חשש? אם התשובות לא מאפשרות קבלת החלטה, לא ניתן יהיה למסחר את המוצר. אם יובילו להחלטה שגויה ויקרה בעקבות זאת אירוע בטיחותי, ייפגע כל התחום. אני חושב שהחברות לא משקיעות מספיק בחידוד הסוגיה הזו, ודווקא שם נמצא האתגר האמיתי".
נראה כי הרשות תחת ההנהגה שלך הייתה הרבה יותר אקטיבית.
"רציתי שהרשות תהיה כזו שיש בה מחקר, וכך מדען שמגיע לרשום את המוצר של החברה שלו, יפגוש מולו מדען שגם הוא חוקר פעיל בתחום. זו שיחה ברמה אחרת. אנחנו משקיעים כיום 50 מיליון דולר בהקמה של מאגר מידע מהעולם האמיתי, שממנו נוכל לגזור נתונים להשוואה בניסויים שבהם אין אפשרות לגייס קבוצת ביקורת. חשבנו תחילה שנסרוק לתוך המאגר 10 מיליון רשומות רפואיות אמיתיות, אך כנראה נגיע להרבה יותר.
"קיבלנו עוד 40 מיליון דולר כדי ליצור מאגר מידע של כל ההחלטות שכבר קיבלנו. די מדהים שעד היום כדי לדעת אם כבר בחנו סוגיה בעבר, היינו צריכים לקרוא לאחד המומחים הוותיקים ופשוט לשאול אותו ‘ראית פעם משהו כזה?'".

מעבדה של רשות המזון והתרופות במרילנד/ צילום: רויטרס
לקרב בין ה-FDA לבין הרשויות בישראל
כמו בכירים רבים בתחום הבריאות שמגיעים לישראל, גם גוטליב שופע מחמאות לתעשייה הישראלית. "כבר בביקור הראשון שלי כאן ב-2003 ראיתי זירת טכנולוגיה רפואית תוססת, ומאז החברות רק התרבו והשתפרו. ישראל מובילה בתחומים כמו תרפיה גנטית, טיפול בתאים, יש כאן פלטפורמות טכנולוגיות נהדרות שאין דומה להן בעולם".
עם זאת, הוא לא חושב שזו סיבה טובה להקים סניף של ה-FDA בישראל, כפי שהציעו לאחרונה מספר גורמים בתעשיית הביומד. "זה לא יהיה יעיל ומשתלם במיוחד. ה-FDA מקימה לעיתים סניפים במקומות, כמו הודו וסין, שבהם יש מפעלי ייצור רבים, שצריך לפקח עליהם מקרוב לעיתים קרובות, ובהם כדי להבדיל בין השחקנים הטובים והפחות טובים חייבים להבין את התרבות המקומית, אז אתה חייב שיהיה לך שם מישהו עם הרגליים על הקרקע המקומית.
"בישראל, לעומת זאת, אין מפעלים ואין לנו את הצורך הזה בדיוק, אלא הצורך של החברות החדשניות הישראליות לנהל תהליך יותר נגיש של רישום מוצרים חדשים. את זה ניתן להשיג על ידי שיתוף-פעולה ואיחוד תקנות בין ה-FDA לבין משרד הבריאות הישראלי. הכוונה היא שניסויים שייערכו בארץ יבוצעו מלכתחילה כך שגם אנחנו נוכל לקבל אותם. יש לנו שיתופי-פעולה כאלה מול אירופה, מול אוסטרליה, וכעת אני נמצא בקשר עם שגרירות ארה"ב בישראל כדי לקדם את הכיוון הזה. אולם, אני חושב שכדאי להתחיל בקטן, בכמה דוגמאות, ולא בהסכם מסגרת שיחתם בין ההנהלות".
כבר לא שומעים עליכם כל כך הרבה תלונות, לפחות מן החברות הישראליות. מזמן לא שמעתי שאתם בלתי צפויים, לא שקופים וביורוקרטים לא לצורך. זה אתם, או שאנחנו התרגלנו?
"נראה שהבעיה היום של חברות שיש להן מוצר טוב באמת, היא לא עם הרגולציה. הבעיה מגיעה כשהן נתקלות בחברות הביטוח, בעיקר אם התרופה יקרה. חברה אחת תאשר, אחרת לא, והביטוח הממשלתי יהיה האחרון לשחרר את המימון, ואז יש הפליה סוציו-אקונומית, וזו בעיה.
"הייתי רוצה לראות מצב שבו חברות הביטוח מקבלות אישור לשלב סיכון, לערוב זו לזו, כדי שאף אחת מהן לא תצטרך לחשוש ממימון של תרופה חדשה. אם הציבור יחשוב שהתרופות החדשות הן לעשירים בלבד, תהיה סערה ציבורית גדולה. אם זו תרופה שיכולה לשנות את מסלול חייו של ילד, על אחת כמה וכמה תהיה לזה תגובה ציבורית ופוליטית".
עם זאת, גוטליב לא תומך בחקיקה להפחתת מחירי התרופות. על הצעת החוק האחרונה שהוגשה בתחום זה כתב בטוויטר: "אם החוק יעבור וחברות ביוטק ייראו החזרים עתידיים נמוכים יותר, הן לא יוכלו לגייס את ההון הדרוש לקחת את הסיכונים הגדולים באמת, וטכנולוגיות פורצות דרך, כמו עריכה גנטית, לעולם לא יגיעו לשוק".
אחת הסערות הציבוריות שבהן נתקלת בקדנציה, הייתה חוק ה"זכות לנסות", שאומר שכל אדם זכאי לטיפול בכל תרופה, גם אם לא עברה אישור, אם זו תקוותו האחרונה.
"המטרה של החוק הזה הייתה להוציא את ה-FDA מהתמונה. אמרו לנו - ‘אנחנו לא רוצים את התרומה שלכם כאן'. אחר כך התחרטו ואמרו לנו - ‘כן רוצים אתכם'. אבל אנחנו אמרנו - לא נוגעים בזה. מי שרוצה את זה - בבקשה.
"לנו יש את מסלול ה-Expanded access, שבו חברות יכולות לתת את הטיפול שלהן לחולים ללא תקווה - גם אם אין להן אישור. אני חושב שהמסלול הזה בכלל לא מסובך. עשינו כל מה שאפשר, על חשבוננו, כדי להנגיש את התוכנית הזו לכל רופא.
"מה שקרה לחוק הזכות לנסות מאז שחוקק, הוא שלחברות לא הייתה כמות מוצר מספקת כדי לתת לחולים שרצו לנסות. לכן במקרים רבים האישור לא הוביל לניסיון אמיתי. אני חושב שאם תוכנית ה-Expanded access תחלחל בהדרגה והחברות יראו שיש ביקוש למוצריהן, אולי עבורה הן כן יסכימו ליצר כמות מסוימת של המוצר שלהן במיוחד, אך ייתכן גם שלא.
הזכות להשתמש בתרופות ניסיוניות
"אני חושב שמספר חברות רצו להשתמש בחוק הזכות לנסות כדי למכור מוצרים שלא היה להן ביטחון שבאמת יאושרו. זה בוודאי לא דבר טוב, אך בטרם אגבש דיעה סופית על החוק, אני רוצה לראות אילו חברות משתמשות בו, ובאילו נסיבות".
ישנם מוצרים רבים מבוססי צמח בשוק, שטוענים במישירין או במובלע לסגולות רפואיות. האם בתקופתך עבדתם על בניית מסלול רישום מסודר עבורם?
"יש לנו מסלול רישום לתרופות ממקור צמחי, ושם אני לא רואה סיבה לשינוי משמעותי. באשר למוצרי מזון או צמחים שהיצרנים שלהם מגיעים כמעט עד קו הגבול החוקי בטענות הבריאות לגביהם, אנחנו אישרנו אותם לשוק, אך כעת האתגר הוא של הצרכן. ישנן המון חברות שטוענות טענות ללא הוכחות, בעיקר במוצרים להפחתת משקל".
מי שיצטרך לקבל את ההחלטות בכך העניינים האלה כבר לא יהיה גוטליב, אלא ממשיך דרכו, ד"ר ברט גירויר, שמונה השבוע לתפקיד.
למה עזבת את התפקיד אחרי קדנציה קצרה יחסית, כשנראה היה שכל השינויים שהתחלת נמצאים בדיוק בשיא תנופתם?
"הייתי רחוק מהבית, מהמשפחה שלי. זה נהיה קשה".
מה היית מייעץ למחליפך?
"הדבר הכי חשוב עבורו הוא להבין איך עובדים בוושינגטון. התפקיד מאוד פוליטי, חובה להבין איך באמת מעבירים חוקים. כל מי שנכנס לתפקיד חייב ללמוד את זה, ומהר".
היום גוטליב הוא שותף בקרן הון הסיכון הפעילה New Enterprise Associates ובביקורו בישראל פגש חברות ישראליות שהוא שוקל להשקיע בהן. "הקרן שלנו אוהבת להשקיע בתחומים שעד היום לא היו אטרקטיביים בגלל הסיבוך בדרך לרגולציה או לקבלת שיפוי. ייתכן שאנחנו נוכל לעזור להתיר את החסמים הללו".
גוטליב הגיע לישראל לכנס של בנק ההשקעות HC Wainwright. לדברי עודד ספינדל, סגן נשיא הבנק, "ישראל מהווה מרכז טכנולוגי אינובטיבי משמעותי מאוד מבחינתנו. HCW מחויב מאוד כבר מספר שנים לשוק ההון המקומי בישראל, בייחוד בתחום מתחום מדעי החיים, עם קשרים ארוכי טווח עם חברות רבות ומשקיעים בישראל".
מתנגד לסיגריות האלקטרוניות, סקפטי לגבי קנאביס
ד"ר סקוט גוטליב נחשב למי שהטיל הגבלות קשות על תחום הסיגריות האלקטרוניות ומוצרי העישון באידוי. הוא הצהיר בעבר, כי ישנה "מגיפה של עישון סיגריות אלקטרוניות אצל בני הנוער". לאחרונה התבטא גוטליב בטוויטר: "בעיית הסיגריות האלקטרוניות היא בעיקר בעיה של חברת ג'ול. הם הרסו את עיקרון 'הפחתת הסיכון' עבור כולם".
בשיחה מסביר סקוט כי ה-FDA היה פתוח לרעיון שניתן להפחית את נזקי העישון על ידי מעבר לסיגריות אלקטרוניות, אצל מי שכבר מעשן. אמנם, הוא אומר, עוד אין הוכחות חותכות לכך שהתועלות בריאותיות אכן קיימות לטווח הארוך, אך יש בזה היגיון ואי-אפשר לשלול זאת. אולם, כדי לממש פוטנציאל התועלת זה, היה על החברות להיזהר מאוד לא למכר מעשנים חדשים לסיגריות האלקטרוניות, על אחת כמה וכמה - ילדים ונוער.
"ב-2018 הייתה ירידה בכמות המשתמשים הצעירים ולפתע ב-2019 - שוב עלייה חדה. בני הנוער נמשכים בעיקר למוצרים בטעמים, למשל מנטה, ולמוצרים שיש להם מחסנית שאפשר גם להעמיס בחומרים אחרים - הם מוסיפים לה קנאביס וחומרים גרועים יותר. לכן אנחנו צריכים לבטל את המוצרים הכי אטרקטיביים לילדים".

חנות סיגריות אלקטרוניות בארה"ב/ צילום: רויטרס
בתגובה לראיון הזכירו גורמים מהתעשייה, כי גוטליב הוא היום דירקטור בחברת פייזר, שמשווקת התרופה נגד עישון צ'מפיקס, וכי הטענה לפיה ישנה "מגפה" של שימוש בסיגריות אלקטרוניות על ידי צעירים היא שנויה במחלוקת. והמבקרים מציינים עוד כי אם ישנה עלייה קלה בשימוש בסיגריות אלקטרוניות בקרב צעירים בארה"ב, הרי שבמדינות אחרות אין מגמה כזו ולכן הבעיה היא אולי אכיפה ולא המוצר.
מחברת ג'ול בישראל נמסר, שהחברה "משווקת את מוצריה כחלופה עבור מעשנים בגירים בלבד, אשר לא הצליחו להפסיק לעשן ופועלת תמיד במסגרת החוק ובהתאם לרגולציה המקומית. מרגע השקתה לקחה על עצמה החברה רגולציה עצמית מחמירה, על מנת לוודא שמוצריה יגיעו אך ורק למעשנים בגירים ונקטה צעדים יזומים וחסרי תקדים בשוק על מנת למנוע גישה של צעירים למוצריה".
גוטליב הוא לא מעריץ נלהב של תחום הקנאביס, בעיקר לא באופן שבו מתפתח השוק בארה"ב, כהרחבה של שוק הפנאי. לאחרונה אמר כי: "בטיחות היא מעל הכול וטענות יש לעגן במדע. קנאביס לא בהכרח בטוח ורוב הטענות לגבי תועלותיו, לא הוכחו, למעט במספר קטן של אינדיקציות. רוב טענות התועלת של המגדלים הלא חוקיים לעולם לא יוכחו". זאת, הן משום שחלקן לא נכונות, והן משום שאין תמריץ בשוק להשקיע בהוכחה מדעית שלהן, כל עוד הציבור צורך את המוצר ממילא.
תעודת זהות ד"ר סקוט גוטליב
בן 47, גדל בניו ג'רזי, נשוי + שלוש ילדות ● למד לתואר ראשון בכלכלה ב-Wesleyan Universty בקונטיקט ורק לאחר מכן למד רפואה בבית הספר לרפואה Ichan, המסונף לבית החולים מאונט סיני בניו יורק ושם גם עשה התמחות ברפואה פנימית ● אחרי לימודי הכלכלה שימש כאנליסט לתחום הבריאות בבית ההשקעות אלקס בראון ● לאחר לימודי הרפואה עבד בבית החולים מאונט סיני ובבית החלים Tisch בניו יורק ● מונה ליועץ לראש ה-FDA ב-2002 ואחר כך שימש בתפקידים שונים ברשות ● הוא שותף בקרן הון הסיכון NEA, דירקטור בחברת פייזר , עמית בצוות החשיבה השמרני American Enterprise Institute ● פרש מתפקיד ראש ה-FDA כדי לבלות יותר עם משפחתו